Implante subcutâneo de testosterona

Artigo na integra acesse o link: http://www.moreirajr.com.br/revistas.asp?fase=r003&id_materia=3388
Subcutaneous testosterone implant
Eduardo José Andrade Lopes
Membro titular da Sociedade Brasileira de Urologia. Chefe do Departamento de Andrologia do Hospital Universitário Professor Edgard Santos – Universidade Federal da Bahia. Doutorando em Ciências pela Universidade de São Paulo – USP/SP.
Tarsila Carvalho dos Santos
Estudante da Faculdade de Medicina da Universidade Federal da Bahia. III ano.
Plínio Moreira de Góes
Médico assistente da Divisão de Clínica Urológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP).
Miguel Srougi
Professor titular da Divisão de Clínica Urológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP).
* Conhecido por “silastic” – Fabricado pela Dow Corning Corp., Midland, Michigan, NM, USA.
Trabalho realizado no Departamento de Urologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP).
Endereço para correspondência:
Eduardo José Andrade Lopes
Rua Altino Seberto de Barros, 241
Edifício Memorial Itaigara – salas 405/406
CEP 41850-010 – Salvador – BA
Telefax: (71) 3517424
E-mail: ejalopes@terra.com.br
Recebido para publicação em 07/2005.
Aceito em 09/2005.
© Copyright Moreira Jr. Editora.
Todos os direitos reservados.
RBM Ago 06 V 63 N 8
págs.: 434-438
Unitermos: implantes, silastic, testosterona, hipogonadismo, deficiência androgênica
Unterms: pellets, silastic, testosterone, hypogonadism, androgenic deficiency.
RESUMO
O implante subcutâneo de testosterona dentro de tubos de silicone é considerado como uma via alternativa para a reposição hormonal quando se pretende uma ação prolongada. Vários autores defendem essa via como a melhor opção.
A literatura médica sobre implante subcutâneo de testosterona foi revisada usando os estudos publicados no Medline.
A absorção regular é defendida e tem seu uso justificado pela manutenção dos níveis fisiológicos das testosteronas e pela menor variação da globulina transportadora do hormônio sexual (SHBG).
Apesar das dúvidas quanto a sua farmacodinâmica e farmacocinética, e a metodologia considerada inadequada, os implantes são usados por autores que defendem o implante subcutâneo de testosterona como a melhor opção para tratamento de casos selecionados de hipogonadismo.
PRODUÇÃO
A testosterona colocada dentro de pequenos tubos de silicone* (silastic) pode ser implantada no subcutâneo sob anestesia local, em pacientes que necessitam fazer reposição hormonal em caráter definitivo. O implante subcutâneo foi um dos primeiros e efetivos métodos de reposição clínica da testosterona (Parkes, 1938 apud Handelsman et al., 1997). Outros esteróides bioativos, incluindo estrógenos, progesterona e mineralocorticóides de depósito, foram usados por diversos autores com a mesma finalidade (Emmers 1941 apud Handelsman et al., 1990).
Os implantes originais de testosterona eram confeccionados sob alta pressão e em forma de tabletes contendo esteróide cristalizado puro, usando o colesterol como excipiente (Loeser, 1940 apud Handelsman et al., 1990; Bishop e Foley, 1951). Eram frágeis, quebradiços, difíceis de produzir de forma padronizada e de esterilizar. Exibiam uma superfície desigual, fragmentavam-se durante a absorção in vivo e produziam uma irregular e tardia taxa de liberação hormonal (Emmens, 1941 apud Handelsman et al., 1990).
As limitações foram superadas, parcialmente, a partir de 1950, com a confecção de testosterona fundida (sem excipientes) sob altas temperaturas e colocadas dentro de moldes cilíndricos, produzindo implantes mais robustos. Tinham uma composição mais uniforme, resultando em uma liberação mais constante e prolongada com redução da reação tissular.
Apesar da grande biodisponibilidade, para uso clínico, poucos ensaios (Swyer, 1953; Reiter, 1946 apud Handelsman et al., 1990), e somente um estudo farmacológico simples de implantes de testosterona subcutâneo (Bishop e Foley, 1951) foi reportado até 1984; quando estudos farmacológicos (Handelsman et al., 1990; Jockenhovel et al., 1996) e clínicos (Cantrill et al., 1984; Conway et al. 1988; Handelsman et al., 1997; Zacarin e Warne, 1997) redefiniram sua farmacologia clínica e aplicações.
Técnica
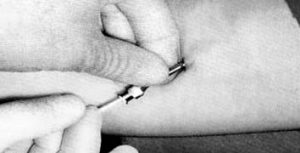
A esterilização dos implantes é obtida pela combinação da exposição às altas temperaturas durante a fabricação e a esterilização de superfície pela irradiação gama. Os tubos de silicone* (Figuras 1 e 2) são disponíveis em vários tamanhos (15 a 30 mm) e diâmetros (2,4 a 4,5 mm), contendo diferentes dosagens de testosterona (Figuras 1 e 2).
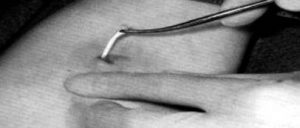
Os tubos contendo o hormônio são colocados sob condições estéreis, anestesia local e regime ambulatorial usando um trocar e cânula (Figuras 3 e 4). Podem ser usados implantes subcutâneos, contendo testosterona na dose de 8-10 mg/kg de peso (Zacharin e Warne, 1997). Os locais de preferência são: parede lateral do abdome inferior, região glútea, face interna do antebraço, deltóide e parte alta da coxa (Coutinho et al., 1981; Handelsman et al., 1997; Zacharin e Warne, 1997).
Alguns autores preferem fazer o implante subcutâneo na face lateral externa das nádegas por ser uma região que fica coberta pelas roupas íntimas. Cosmeticamente é preferível por ser pouco visível externamente e o mesmo local pode ser reutilizado em um novo implante usando a mesma incisão (Handelsman et al., 1997).
O implante subcutâneo tem poucos efeitos colaterais e são geralmente bem tolerados (Zacharin e Warne, 1997; Handelsman et al., 1997). Em uma revisão de 973 implantes consecutivos estudados em 221 homens durante 13 anos, a taxa de sucesso foi na média de 93% (Handelsman et al., 1997). Os mais freqüentes eventos adversos relatados foram extrusão (8,5% por procedimento ou 2,5% por tubo), sangramento (2,3%) e infecção (0,6%) em 973 procedimentos usando testosterona cristalina fusionada. Os implantes foram colocados, no entanto, por mais de dois cirurgiões. A extrusão geralmente ocorre dois meses após a colocação, no local da incisão ou acima do final do tubo onde a pele fica mais fina. Depende, principalmente, da experiência de quem fez o procedimento e de uma maior atividade física do paciente. A fibrose é muito pouco freqüente com os atuais implantes. Em mais de 1.000 procedimentos, nenhuma reação alérgica ou formação de quelóide foi relatada (Handelsman et al., 1997). Outro autor, em uma série menor, não teve nenhum caso de extrusão ou fibrose em 156 implantes realizados em homens adolescentes hipogonádicos (Zacharin e Warne, 1997).
Figura 1 – Cápsulas de silicone contendo hormônio para contracepção. À esquerda, minimplantes contendo 18 mg; no meio, implante único contendo 3 mg de estrógeno; e à direita, um conjunto de seis implantes de 30 mm.
Figura 2 – Conjunto de tubos de silicone contendo hormônio de liberação lenta.
Figura 3 – Introdução de implante tubular através de uma agulha usada em raquianestesia.
Figura 4 – Retirada de implante tubular através de pequena incisão na pele.
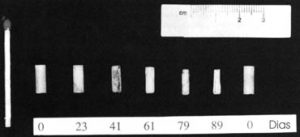
Figura 5 – Sete implantes cilíndricos contendo 200 mg de testosterona, confeccionados com esteróide cristalino sem excipiente (Organon Pty Ltd). Os implantes exibem formas diferentes devido ao uniforme mecanismo de erosão superficial proporcional ao número de dias em que ficaram debaixo da pele.
Absorção
A maior crítica a esta via de reposição é a dificuldade para se estimar a taxa de liberação e absorção hormonais. Empíricas estimativas foram realizadas por uma avaliação residual dos implantes extruídos (Figura 5).
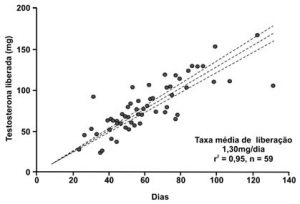
Para cada tubo contendo 200 mg de testosterona, a taxa estimada de absorção foi de 1,3 mg/dia, baseada no peso remanescente de 59 implantes extruídos que exibiram taxa linear de absorção durante mais de cem dias após implantação (Handelsman et al., 1990) (Figura 6).
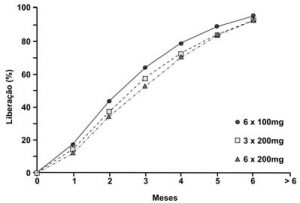
A absorção é quase linear com os três regimes de implantes (Figura 7) e um tempo médio estimado de 75 dias com a metade da dose contida em cada tubo; além de uma taxa de liberação hormonal de 1,3 mg/dia para os implantes contendo 200 mg de testosterona. O número de implantes não influencia a taxa de absorção (Handelsman et al., 1997). Outros autores encontraram uma taxa de absorção diferente (Bishop e Foley. 1951), que pode estar relacionada à diferença de composição dos implantes, além de características específicas de absorção de cada local, já que falta um estudo padronizado; e que não guarde uma diferença temporal tão grande quanto a dos autores acima. Os resultados são similares aos encontrados em mulheres que foram submetidas a implantes únicos de 100 a 200 mg de testosterona (Thom et al., 1981; Dewis et al., 1986). São taxas estimadas indiretamente pela dosagem das concentrações sangüíneas das testosteronas, após correção das diferenças relativas ao sexo pelas taxas de clearence do hormônio (Southren et al., 1968; Gandy, 1977 apud Handelsman et al., 1990).
O implante subdérmico de testosterona tem uma biodisponibilidade completa que é avaliada pelas dosagens sangüíneas do hormônio (Handelsman et al., 1990 e 1997). A esta completa biodegradabilidade dos implantes, associa-se a vantagem da absorção do hormônio, diretamente para a corrente circulatória, evitando a metabolização e inativação hepática decorrente do efeito da primeira passagem pelo fígado (Handelsman et al., 1990 e 1997).
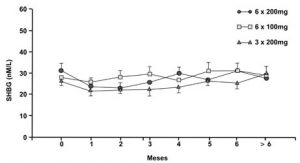
O SHBG permanece inalterado (Figura 8), mantendo uma taxa do clearence de testosterona em 540 L/m2/dia durante toda a vida útil de um implante de 200 mg (Handelsman et al., 1990).
Figura 6 – Taxas de liberação de testosterona foram estimadas pela avaliação direta do peso dos implantes antes e após sua extrusão, e relacionados com o número de dias a partir da sua colocação subcutânea. Os implantes extruídos eram limpos, secados e pesados para determinar a massa de testosterona liberada em comparação com a função linear do tempo (r2 = 0,95, n = 59) acima de 120 dias. A taxa de testosterona liberada variou de 1,22 a 13,7 mg/dia; e, na média, 1,3 mg/dia por implante de 200 mg [Fonte: Handelsman et al., 1990].
Figura 7 – A testosterona sérica foi mensalmente avaliada durante seis meses em homens hipogonádicos submetidos a três regimes diferentes de implantes. A taxa de liberação foi similar em todos os grupos avaliados [Fonte: Handelsman et al., 1990].
Figura 8 – Níveis da SHBG após implantação de diferentes concentrações hormonais de implantes em 43 homens hipogonádicos, seguidos durante mais de seis meses [Fonte: Handelsman et al., 1990].
A completa absorção da testosterona implantada pode ser calculada pelas dosagens sangüíneas das testosteronas total e livre. Vários estudos foram realizados para avaliar a absorção em diferentes locais, assim como a variação da taxa de liberação e duração da ação dos implantes de 100 e 200 mg de testosterona (Bishop e Foley 1951; Conway et al., 1988; Handelsman et al., 1990; Jockenhovel et al. 1996).
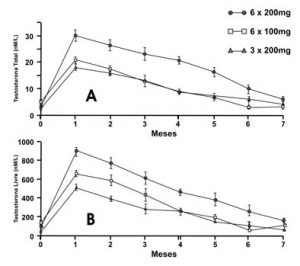
Com resultados semelhantes, formulações de depósitos contendo diferentes esteróides foram testadas e vêm sendo usadas por diversos autores desde 1969 (Coutinho et al., 1970, 1972 e 1981; Burris et al., 1988). A manutenção da libido, potência e sensação de bem-estar são obtidas de forma consistente por ambas as posologias de terapia de reposição, usando-se 600 mg durante quatro a cinco meses ou 1.200 mg durante seis meses (Handelsman et al., 1990) (Figura 9).
Figura 9 – Níveis de testosterona, em 43 homens hipogonádicos, seguidos durante sete meses em uso de três concentrações diferentes de implantes. (A) testosterona total; e (B) testosterona livre [Fonte: Handelsman et al., 1990].
Indicação
Implantes de tubos contendo testosterona são particularmente indicados em homens com deficiência androgênica, que não gostem ou não se sintam habilitados a fazerem uso de injeções regulares, nem uso diário de gel ou adesivos. A grande maioria dos homens jovens e idosos prefere continuar com o uso dos implantes do que retornar às aplicações intramusculares de testosterona (Conway et al., 1988; Handelsman et al., 1990; Jockenhovel et al., 1996; Zacharin e Warne, 1977).
Devido ao inconveniente da longa ação e da necessidade de remoção cirúrgica, implantes devem ser usados por homens, cujos benefícios e tolerância, com a terapia de reposição androgênica, já tenham sido bem estabelecidos pelo tratamento com preparações contendo testosterona de ação curta. A necessidade de uma pequena cirurgia para a remoção dos implantes é uma limitação do método (Handelsman et al., 1990 e 1997).
CONCLUSÃO
Apesar das dúvidas existentes quanto à farmacodinâmica e farmacocinética dos implantes subcutâneos, alguns autores (Plymate et al., 1983; Conway et al., 1988) relataram 20% a menos de alteração na globulina transportadora do hormônio sexual (SHBG) em pacientes usando esta modalidade de reposição, quando comparados com a via intramuscular. Concluíram que a menor variação na SHBG obtida com o implante subcutâneo é conseqüência de uma absorção mais regular que evita os picos e quedas observados quando a testosterona é administrada pela via intramuscular (Cantrill et al., 1984; Handelsman et al., 1997). Os implantes subcutâneos, apesar das dúvidas quanto à taxa de liberação hormonal estudadas de maneira empírica, são largamente utilizados em vários países (Bagatell e Brenner, 1996; Handelsman et al., 1997).
Bibliografia
1. Bagatell CJ, Brenner WJ. Androgens in men – uses and abuses. N. Engl. J Med., 1996; 334(11):707-14.
2. Bishop PMF, Foley SJ. Absorption of hormone implantes. Lancet. 1951; ii: 229-32.
3. Burris AS, Ewing LL, Sherins RJ. Initial trial of slow-release testosterone microspheres in hypogonadal men. Fertil Steril. 1988; 50:493-7.
4. Cantrill JA, Dewis P, Large DM, Newman M, Anderson DC. Which testosterone replacement therapy? Clin Endocrinol. 1984; 21(2):97-107.
5. Conway AJ, Boylan LM, Howe C, Howe C, Ross G, Handelsman DJ. Randomized clinical trial of testosterone replacement therapy in hypogonadal men. Int J Androl. 1988; 11(4):247-64.
6. Coutinho EM, Mattos CE, Sant’Anna AR, Adeodato Filho J. long-term contraception by subcutaneous Silastic capsules containig megestrol acetate. Contracption. 1970; 2:313-21.
7. Coutinho EM, Mattos CE, Sant’Anna AR, Adeodato Filho J, Silva MC, Tatum HJ. Further studies on long-term contraception by subcutaneous Silastic capsules containing megestrol acetate. Contraception. 1972; 389-93
8. Coutinho EM, Silva AR, Carreira CMV, Sivin I. Long term contracption with a single implant of the progestin ST-1435. Fértil Steril. 1981; 36: 737-40.
9. Dewis P, Newman M, Ratcliffe WA, Anderson DC. Does testosterone affect the normal menstrual cycle? Clin Endocrinol (Oxf). 1986; 24(5):515-21.
10. Emmens W. Rate of absorption of androgens and estrogens in free and esterified form from subcutaneously implanted pellets. Endocrinology. 1941; 28:633-42.
11. Gandy HM. Androgens. In: Fuchs F, Klopper A. ed. Endocrinology of pregnancy. 2 ed. Hagerstown: Harper & Row; 1977; 123-56.
12. Handelsman DJ, Conway AJ, Boylan LM. Pharmacokinetics and pharmacodynamics of testosterone pellets in man. J Clin Endocrinol Metab. 1990; 71(1):216-22.
13. Handelsman DJ, Mackey MA, Howe C, Turner L, Conway AJ. An analysis of testosterone implants for androgen replacement therapy. Clin Endocrinol (Oxf). 1997; 47(3):311-6.
14. Jockenhovel F, Vogel E, Kreutzer M, Reinhardt W, Lederbogen S, Reinwein D. Pharmacokinetics and pharmacodynamics of subcutaneous testosterone implants in hypogonadal men. Clin Endocrinol. 1996; 45(1):61-71.
15. Parkes AS. Effective absorption of hormones. Br J Med. 1938; 371-3.
16. Plymate SR, Leonard JM, Paulsen CA, Fariss BL, Karpas AE. Sex hormone binding changes with androgen treatment. J Clin Endocrinol Metab. 1983; 57:645-8.
17. Reiter AA. The male climacteric: report of two hundred and seventy-tree cases. J Am Med Assoc. 1946; 132:188-91.
18. Southern AL, Gordon GC, Tochimoto S. Further study of factors affecting the metabolic clearence rate of testosterone in men. J Clin Endocrinol Metab. 1968; 28(8):105-12.
19. Swyer GI. Effects of testosterone implants in men with defective spermatogenesis. Br J Med. 1953; 14:1080-1.
20. Thom MH, Collins WE, Studd JW. Hormonal profiles in postmenopausal women after therapy with subcutaneous implants. Br J Obstet Gynecol. 1981; 88(4):426-33.
21. Zacharin MR, Warne GL. Treatment of hypogonadal adolescent boys with long acting subcutaneous pellets. Arch Dis Child. 1997; 76(6):495-9.